Казалось бы, при чем тут автомобиль?
Производство электроэнергии путем сжигания органического топлива и использования полученной теплоты для совершения работы в двигателе, вращающем электрогенератор, с точки зрения логики не является простейшим путем превращения химической энергии в электрическую. По сути своей, любая реакция есть переход электронов между атомами. А направленный поток электронов есть электрический ток.
Прямое превращение энергии химических реакций в электричество реализуют в топливном элементе (ТЭ), в принципе состоящем из двух электродов и электролита между ними.
В отличие от аппаратов специального назначения (спутники, подводные лодки и другие специфические объекты), при создании которых основным критерием является надежность, а вопросы стоимости не являются главными и в качестве окислителя можно использовать чистый кислород, для гражданских энергетических объектов наиболее приемлемым окислителем является воздух. Энергоустановки на топливных элементах твердооксидным (ТОТЭ) электролитом, в которых он является окислителем, доведены сегодня до массового промышленного применения в связи с тем, что в качестве горючего в них может служить смесь Н2 и СО, называемая синтез-газом. Теоретически ее можно получить из любого углеводородного топлива, проще всего – из газообразного, например, из природного газа. Последний часто состоит почти из чистого метана (до 99 %).
В промышленности широко применяется способ получения синтез-газа из метана (природного газа) путем его каталитической конверсии водяным паром по реакции СН4+Н2О = СО + 3Н2. Для такой конверсии нужны источник воды и генератор пара с высокой температурой, что не всегда удобно применительно к атмосферным топливным элементам малой мощности, используемым в условиях автономной работы без присутствия человека (например, питание станций катодной защиты или базовых станций сотовых операторов). Для таких случаев осуществляют конверсию кислородом воздуха.
Воздушную конверсию (как и паровую) осуществляют в слое никелевого катализатора. В отличие от паровой конверсии, реакция СН4+0,5 О2 = СО + 2Н2 является экзотермичной, выделяющейся в ней теплоты достаточно для нагрева смеси горючего с окислителем примерно до 800 oС, поэтому нужен лишь небольшой предварительный подогрев смеси перед конвертором.
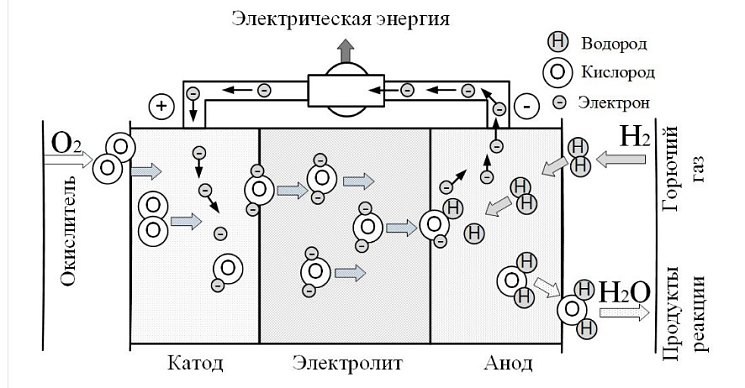
Твердооксидные топливные элементы представляют наибольший интерес для энергетических установок общего назначения так как работают при высоких (800 - 1000 0С) температурах, поскольку только при таких температурах окисляется СО в присутствии катализатора. Используемые твердые электролиты должны обладать рядом специфических свойств, в том числе должны иметь достаточную электрическую проводимость. Приемлемыми свойствами обладают электролиты из оксидов циркония, модифицируемых оксидами иттрия или скандия. У электролита (ZrO2)0,9(Y2O3)0,1 , например, проводимость при 1000 0С σ1273=10-14 Ом-1м-1, а у (ZrO2)0,9(Sc2O3)0,1 σ1273=34 Ом-1м-1 (для сравнения у меди при комнатной температуре σ1273=5,7*107 Ом-1м-1). Рисунок иллюстрирует процессы, протекающие в топливном элементе с твердым электролитом на примере окисления водорода.
Катод и анод выполняются из пористых материалов, подобранных соответствующим образом (соединения лантана, стронция, никеля и др.), пропускающих кислород (катод), водород и СО (анод) к электролиту, а также Н2О и СО2 (анод) от электролита в анодный поток. Катод и анод, должны, как и электролит, иметь достаточную электрическую проводимость. Кроме того, они должны служить катализаторами для диссоциации кислорода (катод) и ускорения реакций водорода и СО с ионами кислорода (анод). Уже есть материалы для анода, которые служат катализаторами, ускоряющими реакцию водяного газа и даже конверсии метана. Дело в том, что молекулы Н2 много меньше, чем СО и СН4, поэтому они легче диффундируют через слой пористого анода и активнее вступают в реакцию с ионами кислорода. Поэтому зачастую СО не только непосредственно реагирует с О2, а еще и способствует образованию Н2 по реакции СО+Н2О=СО2+Н2, а полученный водород реагирует с О2.
Опубликовано по рекомендации Александра Раменского



